Este artículo es una versión preliminar y no ha sido revisado por pares [¿qué significa esto?]. Informa sobre nuevas investigaciones médicas que aún no se han evaluado y, por lo tanto, no deben utilizarse para guiar la práctica clínica.
Resumen Texto completo Info / Historial Vista previa PDF
Resumen
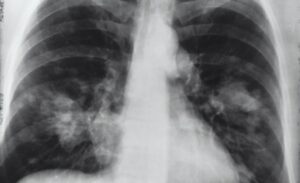
Antecedentes Existe una necesidad crítica continua de mejorar las estrategias terapéuticas para la neumonía COVID-19, particularmente en los pacientes más gravemente afectados. Las infusiones de células madre mesenquimales adultas (MSC) tienen el potencial de beneficiar a los pacientes críticamente enfermos con infección por síndrome respiratorio agudo SARS-COV-2, pero faltan datos clínicos que respalden la eficacia.
Métodos Realizamos un estudio de casos y controles de pacientes críticamente enfermos con COVID-19 confirmado por laboratorio, síndrome de dificultad respiratoria aguda grave (SDRA). Para evaluar la capacidad de respuesta clínica en el paciente más grave, examinamos los resultados en un subgrupo de aquellos que requerían apoyo de oxigenación por membrana extracorpórea (ECMO). Los pacientes (n = 9) recibieron hasta 3 infusiones de MSC intravenosas (IV) y se compararon con un grupo de control ECMO local (n = 31). El resultado primario fue la seguridad y los resultados secundarios fueron la mortalidad por todas las causas (o la tasa de alta hospitalaria), los niveles de citocinas y el aclaramiento viral.
Resultados Las infusiones de MSC (12 pacientes) fueron bien toleradas y no se produjeron efectos secundarios. De los pacientes con ECMO que recibieron infusiones de MSC, 2 de 9 murieron (22,2%; IC del 95%: 2,8%, 60,0%) en comparación con una mortalidad de 15 de 31 (48,4%; IC del 95%: 30,2%, 66,9%; p = 0,25) en el grupo de control ECMO. Los exosomas plasmáticos aislados que contienen la proteína Pico de SARS-COV-2 disminuyeron después de las infusiones de MSC entre el día 14 o 21 después de la administración (p = 0,003 yp = 0,005, respectivamente) y se asoció con una disminución en el título de la proteína Pico de IgG de COVID-19 al mismo tiempo. puntos temporales (p = 0,006 yp = 0,007, respectivamente). Los pacientes de control con ECMO que recibieron plasma convaleciente no eliminaron COVID-19 IgG durante el mismo período de tiempo.
Interpretación En conjunto, estos hallazgos sugieren que la infusión de MSC IV se tolera bien en pacientes con una amplia gama de gravedad, incluido el ARDS por COVID-19 más grave que requiere ECMO. Estos datos también plantean la posibilidad de que las CMM, además de ejercer un efecto inmunomodulador, contribuyan al aclaramiento viral y apoyen firmemente la realización de ensayos aleatorizados controlados con placebo.
Declaración de intereses en competencia
Divulgaciones sobre conflictos de intereses: el Dr. Joshua Hare informó que tiene una patente para la terapia basada en células cardíacas. Tiene acciones en Vestion Inc. y mantiene una relación profesional con Vestion Inc. como consultor y miembro de la Junta Directiva y la Junta Asesora Científica. El Dr. Hare es el Director Científico, consultor remunerado y miembro de la junta asesora de Longeveron y tiene acciones en Longeveron. El Dr. Hare también es el co-inventor de la propiedad intelectual con licencia de Longeveron. A. Khan revela una relación con AssureImmune Cord Blood Bank y Aceso Therapeutic que incluye equidad. El Dr. Sunjay Kaushal es el fundador de Neoprogen. Los otros autores no informan conflictos.
Ensayo clínico
El ensayo se llevó a cabo bajo el IND de emergencia de la FDA (eIND) – 21CFR 312
Declaración de financiación
Financiamiento / Apoyo: Este trabajo fue apoyado por fondos del Instituto Interdisciplinario de Células Madre de la Universidad de Miami, incluido el apoyo de la Fundación Soffer y una subvención interna del Departamento de Cirugía de la Facultad de Medicina de la Universidad de Maryland. Papel del financiador / patrocinador: Las agencias de financiamiento no tuvieron ningún papel en el diseño y la realización del estudio, la interpretación de los datos, la preparación, revisión o aprobación del manuscrito y la decisión de enviar el manuscrito.
Declaraciones del autor
Confirmo que se han seguido todas las pautas éticas relevantes y que se han obtenido las aprobaciones necesarias del IRB y / o del comité de ética.
si
Los detalles del IRB / organismo de supervisión que otorgó la aprobación o la exención para la investigación descrita se proporcionan a continuación:
Los órganos de supervisión / IRB son el IRB de la Universidad de Miami y el IRB de la Universidad de Maryland. Los investigadores han seguido todas las pautas de informes de investigación apropiadas.