El Instituto Mundial de Terapia e Investigación con Células Madre (GIOSTAR), líder mundial en investigación con células madre, se complace en anunciar que han recibido la aprobación para un ensayo clínico COVID-19, dirigido por su director médico, el Dr. Prabhat Soni. GIOSTAR llevará a cabo el ensayo utilizando células madre para tratar pacientes con COVID-19, bajo la aprobación del programa de «acceso ampliado para uso compasivo» de la Administración de Drogas y Alimentos de los Estados Unidos (FDA). El Instituto está explorando un enfoque alternativo prometedor para el trastorno devastador, que aprovecha las propiedades antiinflamatorias de las células madre mesenquimales (MSC). Según el Dr. Soni, la investigación se basa en dos décadas de investigación con células madre por el cofundador, presidente y director científico de GIOSTAR, Dr. Anand Srivastava.
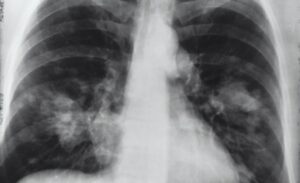
La pandemia de COVID-19 ha resultado en una interrupción sin precedentes, con más de 3 millones de casos y 200,000 muertes reportadas en todo el mundo a partir del 1 de mayo de 2020, una cifra que se proyecta crecer exponencialmente en las próximas semanas. Causada por un virus patogénico conocido como SARS-CoV-2, la infección induce una amplia gama de respuestas en humanos: algunos pacientes son asintomáticos, otros desarrollan molestias leves similares a la gripe y otros sufren de neumonía severa. Los médicos han recurrido a numerosas terapias tradicionales y no convencionales para combatir los efectos de COVID-19. Estas terapias, que incluyen antibióticos y terapia de plasma, han demostrado ser en gran medida ineficaces para controlar la propagación de la pandemia.
Un nuevo enfoque para la inflamación
Dados estos desafíos, como era de esperar, ha habido un aumento en los ensayos clínicos para el uso de MSC para combatir COVID-19. El Centro Médico Cedars-Sinai recientemente citó estudios que «respaldan la idea de que la terapia celular puede atenuar la inflamación, que puede ser atractiva en COVID-19». Un estudio realizado por una coalición internacional de investigadores de China, Estados Unidos, India, Francia y otros países apareció en Envejecimiento y enfermedad, que muestra la recuperación completa de siete pacientes con COVID-19 2 semanas después de recibir la administración intravenosa (IV) de alogénico (de origen externo). de donantes) MSC.
COVID-19 es inducido por una liberación de moléculas de señalización conocidas como citocinas, pequeñas moléculas de proteínas liberadas por las células inmunes para orquestar el modo de «atacar y destruir» de la respuesta del sistema inmunitario del huésped a los patógenos. Las citocinas son proinflamatorias («malas») o antiinflamatorias («buenas»), lo que significa que aumentan o disminuyen los niveles de inflamación en el cuerpo. En el caso de COVID-19, una respuesta inmune no controlada conduce a una «tormenta de citoquinas», elevando drásticamente los niveles de IL-6, IL-8 y TNF-alfa y otras proteínas proinflamatorias. El sistema inmune luego entra en modo de «sobremarcha», causando daños potencialmente fatales a los propios tejidos y órganos del paciente.
Los Dres. Srivastava y Soni buscaron aprovechar y aplicar una amplia investigación que demuestra la efectividad de las MSC en la lucha contra los síntomas respiratorios y las tormentas de citoquinas asociadas con COVID-19. «Las células tienen características específicas que, cuando se infunden en el torrente sanguíneo», explicó el Dr. Srivastava en un video educativo, «neutralizan las citocinas proinflamatorias, regulan negativamente las acciones inflamatorias de los genes (a través de ‘inmunomodulación’) y envían mensajes para regenerar daños tejidos pulmonares «.
Al ver un gran potencial en este enfoque terapéutico, la FDA aprobó el tratamiento basado en MSC para su uso en los casos más graves de COVID-19, bajo su programa de «acceso ampliado para uso compasivo». Los primeros pacientes serán tratados en la ciudad de Nueva York. La ciudad ha estado entre las regiones más afectadas del país, con más de 170,000 casos confirmados de COVID-19 y 13,000 muertes al 1 de mayo de 2020.
«GIOSTAR agradece a la FDA por su acción oportuna en la aprobación del protocolo», señaló el Dr. Soni. «Esperamos compartir los hallazgos de nuestros estudios con el mundo, lo que puede ayudar a salvar muchas vidas en el futuro».
Fuente: Yahoo