La crisis de COVID-19 ha sido un catalizador para una nueva flexibilidad regulatoria en la Administración de Alimentos y Medicamentos de EE. UU. La FDA está presionando agresivamente para desarrollar nuevas vacunas y tratamientos para el coronavirus, que incluyen docenas de ensayos clínicos de terapias con células madre en pacientes críticos.
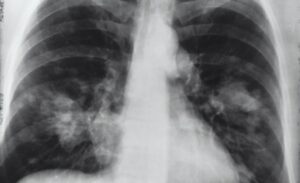
Mesoblast recientemente dosificó a sus primeros pacientes con ventiladores en un ensayo de 300 pacientes utilizando su producto de células madre Remestemcel-L para tratar el síndrome de dificultad respiratoria aguda (SDRA). Pluristem Therapeutics está utilizando células madre derivadas de la placenta en otro ensayo, mientras que The Cure Alliance está utilizando células madre derivadas del cordón umbilical. GIOSTAR tiene un ensayo aprobado para sus células madre mesenquimales bajo el programa de «uso compasivo» de la FDA. Y Athersys ha comenzado una gran prueba con células madre derivadas de la médula ósea en pacientes con SDRA moderado a severo.
La FDA está llevando a cabo una reforma de células madre debido a la pandemia de coronavirus. ¿Pero qué pasa con la crisis de dolor crónico? Alrededor de 50 millones de estadounidenses viven con dolor crónico, en comparación con 1.3 millones de casos confirmados de coronavirus en los EE. UU. Hasta la fecha.
La reforma no es solo el resultado de COVID-19, sino también debido a la presión del pueblo estadounidense, que siempre ha exigido una mayor democracia y autonomía en el tratamiento médico. La voz del pueblo y la virulencia de la pandemia se han fusionado en una verdadera célula madre Martin Luther, el monje alemán que rechazó las enseñanzas de la Iglesia Católica durante la Reforma Protestante.
Al igual que a los que se les dijo que esperaran que la promesa de la terapia con células madre se materializara mientras se inundaba con propaganda sobre tratamientos celulares «no probados», a los cristianos en la era medieval se les dijo que esperaran una salvación controlada por un establecimiento religioso atrincherado, cuando la salvación buscado siempre estaba justo dentro de ellos.
Un aspecto de nuestra actual crisis médica no es nuevo. Los estadounidenses que sufren de dolor crónico intratable han sufrido una crisis perpetua durante una aparente eternidad, esperando que la FDA abandone su enfoque rígido, doctrinario y de talla única para la atención médica en favor de tratamientos más flexibles, innovadores y personalizados.
La crisis de COVID-19, y la consiguiente demanda de soluciones de los estadounidenses, ha forzado la mano de la FDA. Esta demanda obligó a la FDA a reconsiderar su veneración burocrática de las reliquias regulatorias que negaban la novedad revolucionaria de las células madre.
La FDA merece algo de crédito por reconocer finalmente la necesidad de exploración e innovación en sus procedimientos de ensayos clínicos. Pero ahora la agencia debe reconocer que el dolor crónico, como COVID-19, es una crisis médica nacional que requiere una solución creativa similar.
La innovación reguladora de células madre no debe terminar con el coronavirus. De hecho, debe continuar y acelerar. Sí, el progreso actual es alentador. Sin embargo, se debe hacer más. Y debe hacerse de inmediato. La crisis de dolor crónico lo exige.
Fuente: Pain News Network
Por A. Rahman Ford, columnista de PNN