La compañía de biotecnología con sede en Texas Hope Biosciences informó que la Administración de Drogas y Alimentos de los Estados Unidos (FDA) aprobó un ensayo clínico de fase 2 para estudiar la efectividad de las propias células madre de tejido adiposo para el tratamiento de COVID-19.
Estas son las células madre mesenquimales, que también pueden aislarse del cordón umbilical, la placenta y la sangre del cordón umbilical. En Ucrania, el Instituto de Terapia Celular ha desarrollado un protocolo de tratamiento para COVID-19 utilizando células madre mesenquimatosas placentarias multipotentes.
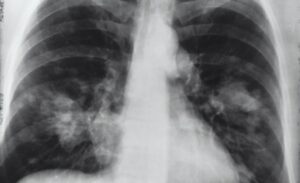
Se ha demostrado que el coronavirus SARS-CoV-2 infecta los vasos pulmonares y se debe restaurar un tracto microcirculatorio dañado para curar a un paciente con neumonía grave por coronavirus. Las células madre mesenquimales tienen la capacidad de reparar tejidos dañados, así como un efecto antiinflamatorio e inmunomodulador prominente.
Hasta la fecha, la terapia celular COVID-19 se lleva a cabo en ensayos clínicos en los Estados Unidos, China, Colombia, Francia y Jordania. Se utilizan células madre mesenquimales, células asesinas naturales, exosomas de células madre mesenquimales. Se han informado unos 30 ensayos clínicos de este tipo y la recuperación se ha informado repetidamente, incluso en pacientes de edad avanzada con COVID-19 grave.
En Ucrania, el Instituto de Terapia Celular está listo para proporcionar 300 dosis de células madre mesenquimales placentarias, que carecen de receptores ACE-2. La ausencia de receptores ACE-2 es una característica muy importante de las células madre mesenquimales placentarias, lo que las hace inaccesibles para el SARS-CoV-2, ya que el coronavirus solo puede atacar las células que contienen un receptor para la enzima convertidora de angiotensina (ACE-2).
Fuente: Cryobank