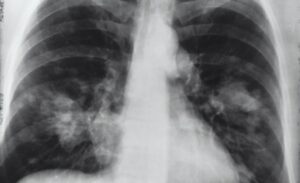
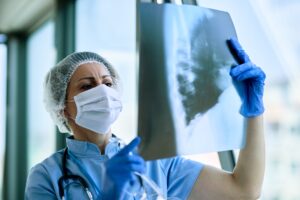
POWAY, CALIFORNIA, EE. UU., 22 de julio de 2020 / EINPresswire.com / – Personalized Stem Cells, Inc. (PSC) recibió la aprobación de la FDA para una solicitud de nuevo fármaco en investigación (IND) para el tratamiento de pacientes con COVID-19 con células madre . El primer ensayo se llama «CoronaStem 1» y brindará tratamiento a 20 pacientes hospitalizados con COVID-19 en California.
El PSC solicitó este IND con la FDA en abril de 2020 a pedido de la Fuerza de Tarea de Coronavirus de la Casa Blanca. El IND acelerado se presentó bajo el recién creado Programa acelerador terapéutico de coronavirus de la FDA (CTAP), que ayuda a acelerar el lanzamiento de ensayos clínicos de la FDA para terapias prometedoras COVID-19. El director médico de PSC, el Dr. Christopher Rogers, declaró: «Con casi 3.9 millones de casos y más de 140,000 muertes en los Estados Unidos, PSC está listo para dar un paso al frente y lanzar este primer estudio para evaluar lo que creemos que es uno de los más Terapias prometedoras. Las células madre tienen el potencial de reducir las complicaciones más graves de la infección por coronavirus «.
Recientemente, el PSC publicó un artículo científico histórico revisado por pares sobre la justificación del uso de células madre para tratar COVID-19 . Con el rápido aumento en los casos positivos, es más importante que nunca obtener nuevas terapias en las pruebas y aprobadas. PSC espera completar rápidamente el estudio CoronaStem 1 y luego pasar a un ensayo clínico de fase 2 más grande y potencialmente a programas de uso compasivo de la FDA para llegar a más pacientes. PSC ya ha aumentado la producción de células madre en sus instalaciones de fabricación de células madre inspeccionadas por la FDA en San Diego para estar listos para tratar a los pacientes.
El CEO de PSC, el Dr. Bob Harman, declaró: “Las dosis de células madre están listas para su uso en ensayos clínicos en pacientes hospitalizados ahora. Nuestros socios médicos comenzarán a tratar a los pacientes en las próximas semanas «. El primer ensayo se llevará a cabo en un número limitado de pacientes hospitalizados por COVID-19 como se describe en la presentación de la FDA, sin embargo, los programas de uso ampliado de la FDA o la autorización de uso de emergencia podrían permitir el tratamiento de muchos más pacientes. PSC no está solicitando la inscripción de pacientes en este momento debido al número limitado de hospitales que se incluirán en el estudio CoronaStem 1.
PSC quiere agradecer a Allan Camaisa (CEO) y al equipo de Calidi Biotherapeutics por proporcionar las líneas de células madre utilizadas para fabricar las células CoronaStem. Su generosa ayuda ha permitido que PSC avance rápidamente. PSC también agradece al personal de la compañía hermana y CRO, VetStem Biopharma, por el soporte de fabricación y regulatorio que hizo realidad esta aprobación.
Acerca de las células madre personalizadas, Inc.
Las células madre personalizadas se formaron en 2018 para avanzar en la medicina regenerativa humana basada en la investigación de su empresa matriz, VetStem Biopharma, Inc. Esta empresa biofarmacéutica privada, con sede cerca de San Diego (California), ofrece médicos calificados quienes se inscriben, un producto de células madre compatible con GMP para su uso en ensayos clínicos aprobados. PSC ha licenciado una cartera de patentes y aplicaciones en el campo de la medicina regenerativa, incluidas las patentes para el tratamiento de COVID-19 y enfermedades pulmonares relacionadas.
Fuente: EIN PRESS WIRE